Une leçon de chimie
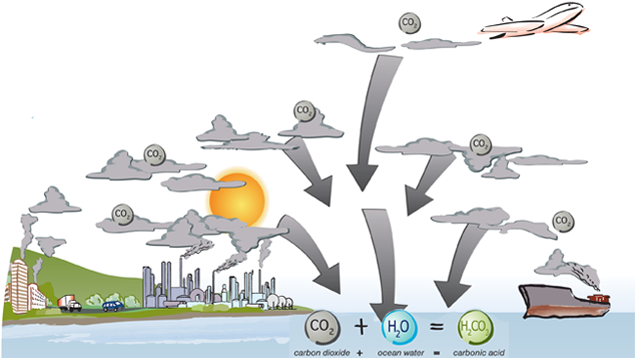
L’océan est l’un des plus grands puits naturels de carbone de la planète. Il absorbe naturellement le dioxyde de carbone dans l’atmosphère et l’entrepose pour des milliers d’années. Toutefois, depuis la Révolution Industrielle, l’océan travaille en surtemps pour essayer de traiter le surplus de dioxyde de carbone émis dans l’atmosphère. Faisons un peu de chimie!
Quand le dioxyde de carbone (CO2) est absorbé par l’océan, il réagit avec l’eau H2O et forme de l’acide carbonique (H2CO3)
CO2 + H2O = H2CO3
L’acide carbonique se désagrège alors en ions d’hydrogène (H+) et en ions de bicarbonate (HCO3-). Cet ion supplémentaire d’hydrogène diminue le PH de la mer environnante ce qui augmente l’acidité. H2CO3 ßà HCO3- + H+
Les ions d’hydrogène se lient avec le carbonate qui se trouve naturellement dans l’eau pour former encore plus de bicarbonate et ainsi encore plus d'acidité. Il y a donc moins de ce carbonate naturel qui serait autrement disponible et nécessaire aux organismes marins pour bâtir leurs squelettes et leur coquilles.
H+ + CO3 ßà HCO3-
Ça semble compliqué mais le résultat est une simple équation chimique qui est observable et prévisible. L’acidification de l’océan a augmenté de 30% depuis la période pré-industrielle et les chercheurs scientifiques croient qu’elle pourrait s’accroître de 150-185% d’ici la fin du siècle si nous ne réduisons pas drastiquement nos émissions de dioxyde de carbone.






